ARTICULO PARA COLEGAS
Crecimiento Normal y Talla Baja
Crecimiento Normal
Conocer el patrón de crecimiento normal de un niño es la base para poder discernir entre un crecimiento normal y uno deficiente. A finales de los años ochenta, se propuso un modelo matemático de la curva de crecimiento conocido como "modelo ICP" (Fetal-Infancy, Childhood, Puberty), según el cual, la curva de crecimiento normal estaría formada por la suma y solapamiento de tres componentes:
- Fetal-primera infancia.
- Prepuberal o de la segunda infancia.
- Puberal.
El objetivo de esta curva es relacionar el crecimiento de cada etapa con los factores biológicos de los que depende y de esta manera poder hacer un diagnóstico más certero de las distintas patologías que alteran el crecimiento.(1)(2)
1 - Fetal - primera infancia:
El crecimiento fetal depende básicamente del espacio para crecer (intrauterino y materno) y de la nutrición que a su vez depende un buen funcionamiento de la placenta.
La insulina estimula el crecimiento fetal por sus efectos anabólicos sobre el metabolismo de glucosa y aminoácidos.
Factores de crecimiento similar a insulina (IGF1y2) actúan en varias etapas del ciclo celular y afectan la proliferación, diferenciación, mantenimiento, regeneración y apoptosis. La producción de IGF durante la vida fetal no es estimulada por la hormona de crecimiento, a partir de los 6 meses de vida comienza a tener un papel relevante en el crecimiento.
Durante los primeros meses de vida el principal factor sigue siendo la nutrición pero también comienza a jugar un papel importante el genotipo (talla familiar y velocidad de crecimiento) por lo tanto se pueden producir aceleraciones y desaceleraciones. La influencia de la GH se va poniendo de manifiesto gradualmente y está presente claramente a los 6 meses de vida extrauterina.
2 - Prepuberal o de segunda infancia:
Existe una reducción de la velocidad de crecimiento durante el período prepuberal que mantiene un crecimiento de 5-7 cm/año durante la mayor parte del tiempo y persiste hasta el estirón puberal, este fenómeno se conoce como depresión prepuberal de la velocidad de crecimiento.
El principal regulador en esta etapa es el eje GH-IGFs, sin embargo entran en juego muchas otras hormonas como insulina, hormonas tiroideas, andrógenos suprarrenales, vitamina D, PTH, glucocorticoides, leptina. Sin embargo también el genotipo influye en esta etapa, los niños con talla familiar baja tienden a crecer con una velocidad de crecimiento inferior al percentil 50 y los de talla familiar alta con velocidades superiores al percentil 50.
3 - Componente puberal:
Se manifiesta con el llamado estirón puberal. En las niñas la aparición de botón mamario marca el comienzo de la pubertad (estadío III Tanner) y coincide en la mayoría de los casos con el estirón. En los varones el inicio lo marca el aumento del volumen testicular, el estirón no coincide con esta etapa, se inicia aproximadamente un año después.
Cabe destacar que una maduración normal, pero adelantada o atrasada respecto a la media, solo modifica la edad a la que se alcanza la talla final, pero no se verá modificada la magnitud de la misma.
En cuanto a lo fisiológico, el componente puberal se debe a la acción de los esteroides sexuales, los cuales tiene una acción directa sobre el cartílago de crecimiento y también incrementando la secreción de GH. Estas hormonas además de ser responsables del estirón también actúan cerrando el cartílago de crecimiento para finalizar el mismo.
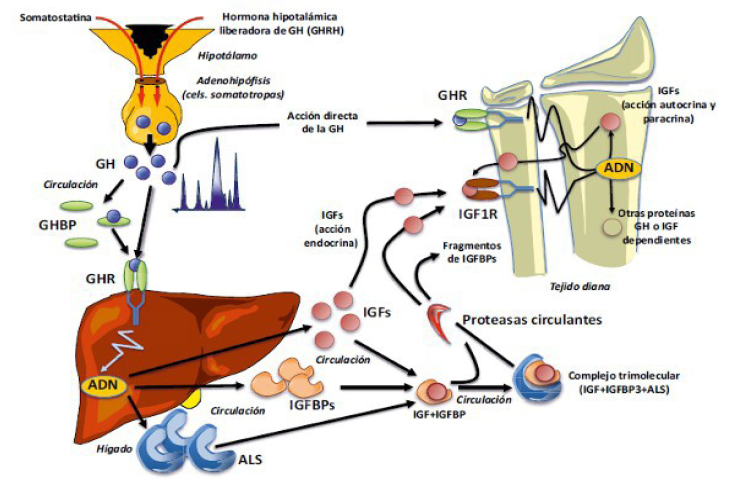
Mecanismo de acción de GH y somatomedinas:
La GH es sintetizada por las células somatotropas de la adenohipófisis y liberada de forma pulsátil (4-6 pulsos secretorios por día) con un predominio durante la noche. Aproximadamente un 50% de la GH circula unida a una proteína de transporte denominada GHBP (growth hormone binding protein) que es idéntica a la porción extracelular del receptor de GH. Posee acciones directas sobre el crecimiento pero la mayoría de sus acciones las realiza a través de las IGFs, especialmente la IGF-1. La GH se une a su receptor en las células e induce la expresión de determinados genes, como IGF-1 a través de distintas vías intracelulares como MAPK, STAT y PI3-K.
Los IGFs, también conocidos como somatomedinas, son péptidos de estructura similar a la insulina.
Se producen en hígado y en algunos tejidos periféricos como el músculo o hueso, y ejercen acciones anabolizantes y mitogénicas sobre las células. Circulan unidas a proteínas de transporte, las IGFBP (IGF binding proteins), la más importante desde el punto de vista clínico es la IGFBP3 ya que transporta del 75 - 90% de los IGFs circulantes. Otra proteína que se une al complejo es la ALS (subunidad-ácido-lábil) formando un complejo de alto peso molecular. Las ventajas de formar este complejo son que aumenta el tiempo de vida media sérica de los IGFs limitando la salida a los tejidos, y evitando los efectos hipoglucemiantes debido a la similitud con la insulina. La salida hacia los tejidos se realiza por la acción de proteasas circulantes que rompen lentamente estos complejos. Tanto las IGF como sus proteínas de transporte se sintetizan en el hígado permitiendo tener niveles constantes durante el día, por lo cual su medida sirve como reflejo de los niveles de GH, al ser ésta última la que estimula su síntesis. Por el contrario la medida de los valores de GH basales no tienen utilidad diagnóstica ya que se libera de manera pulsátil.
Estudio del Niño con talla Baja
La talla baja es un motivo de consulta muy frecuente en pediatría, ya que la estatura de un niño es un parámetro muy útil a la hora de la evaluación del estado de salud del mismo. Un retraso en el crecimiento puede ser una manifestación de alguna patología congénita o adquirida. En la mayoría de los casos se trata de una talla baja idiopática o variante normal, pero en un 5% de los casos puede ser debida a una patología.
Se considera que un paciente tiene talla baja, cuando su talla se encuentra más de dos desvíos estándar (2DE) por debajo del promedio poblacional esperado para su edad y sexo, o por debajo del percentil 3. El 80% de una población de niños cuya talla se encuentra entre -2 y -3 DE corresponde a una variante normal, talla baja familiar o constitucional, en cambio la mayoría de los que se encuentran por debajo de 3DE se considera que tienen una talla baja patológica. (2)(5)
Clasificación de la talla baja: La clasificación más útil es basarse en las causas que se presentan con mayor frecuencia.
| Variantes normales |
|
|---|---|
| Trastornos primarios del crecimiento |
|
| Retraso de la talla secundario a | Enfermedades crónicas
Alteraciones nutricionales
Enfermedades endocrinas
|
Diagnóstico - Pruebas de Laboratorio
La evaluación inicial requiere de pruebas rutinarias de laboratorio con el fin de descartar las causas comunes o silentes que se relacionen con un retraso en el crecimiento. Si se sospecha una enfermedad de base, se deben realizar estudios complementarios orientados hacia esa patología en particular.
En la siguiente tabla se observan las pruebas iniciales para el estudio del paciente con talla baja:
| Pruebas de laboratorio iniciales | |
|---|---|
| Prueba | Diagnóstico diferencial |
| Hemograma completo | Anemia, infecciones |
| Creatinina, ionograma, calcio, fosfatasa alcalina, albúmina | Enfermedades renales, malabsorción, trastornos, del metabolismo fosfo-cálcico |
| Gasometría y PH | Acidosis tubular renal |
| Ac Antitransglutaminasa IgA, Ac antigliadina IgA | Enfermedad celíaca |
| Parasitológico seriado de deposiciones | Malabsorción |
| THS, T4L | Hipotiroidismo |
| IGF-1 | Deficiencia de GH, resistencia a la GH |
| Uroanálisis | Enfermedades renales |
| Cariotipo en las niñas | Síndrome de Turner |
Estudio del eje hipotálamo - hipófisis - GH - IGF-1
Niveles basales de hormona de crecimiento
La secreción de la hormona de crecimiento tiene un patrón pulsátil.
En promedio existen unos seis episodios de secreción, con niveles mayores durante la fase de ondas lentas del sueño. Los niveles entre cada episodio de secreción son muy bajos, alcanzando 1 a 2 ng/ml. Es por esta razón que la determinación al azar de la hormona de crecimiento carece de valor diagnóstico.
No obstante en los recién nacidos se observan valores basales por encima de 20 ng/ml. En este caso un valor bajo de GH sugiere un déficit de la hormona. Esta hipersomatropinemia neonatal, que tiene picos de secreción de alta frecuencia y amplitud, y una larga vida media de la hormona, es probablemente debida a los bajos niveles de IGF-1 y/o a los niveles altos de estrógenos encontrados en las primeras 24 - 48 hs. Hipoglicemia, ictericia prolongada, microfalo y parto traumático son algunos de los datos que pueden hacer sospechar un déficit de GH.
Secreción pulsátil espontánea de hormona de crecimiento: es una prueba que se basa en la utilización de una bomba automatizada de extracción de sangre que permite tomar muestras a intervalos pequeños de tiempo, pudiendo analizar el patrón de secreción durante 12 ? 24 hs. La utilidad de esta prueba fue cuestionada fuertemente debido a que se encontraron variaciones de hasta un 40% intraindividuo al ser analizados en tres o cuatro días consecutivos. En el único caso que puede ser de utilidad es una disfunción neurosecretora, la cual tiene una pobre secreción nocturna de GH, asociada a una respuesta normal a las pruebas de estímulo farmacológico. En general, tiene una baja reproducibilidad y requiere la internación del paciente para tenerlo canalizado por lo menos 24 hs, lo cual la hace una prueba compleja de realizar.
Hormona de crecimiento urinaria
Se excreta en pequeñas cantidades en la orina, aproximadamente un 0,05 % del total circulante en un día. Además tiene una gran variabilidad inter e intraindividuo, sumado al efecto de la función renal, esto hace que sea difícil interpretar sus resultados.
Niveles basales de IGF-1
El IGF-1 es un polipéptido constituido por 70 aminoácidos con una masa molecular de 7.5 kDa. Aunque la expresión de IGF-1 está presente en cada tejido, principalmente es sintetizado y secretado por el hígado (~75 % del IGF-1 circulante) y regulado por la hormona de crecimiento (GH). Aproximadamente el 80 % del IGF-1 del torrente sanguíneo está ligado a un complejo ternario con proteínas de unión al factor de crecimiento insulínico 3 (IGFBP-3) y a una subunidad ácido-lábil (ALS). En este complejo, la vida media del IGF-1 es de alrededor de 1 hora. El 20 % restante de IGF-1 está fijado a IGFBP-3 sin ALS. Solamente un 1 % del IGF-1 no está fijado en absoluto y tiene una vida media de pocos minutos.
Su principal ventaja radica en que mantiene niveles circulantes basales constantes durante las 24 hs, lo que hace que su determinación sea de gran utilidad. Los valores solo tienen variación según edad y sexo. Es considerado por varios autores como la mejor herramienta para tamizaje de déficit de GH en pacientes con talla baja y baja velocidad de crecimiento, de tal forma que valores por debajo de 1DE y excluyendo otras causas o enfermedad crónica sugieren fuertemente un diagnóstico de déficit de GH.
Se utiliza también en el monitoreo de pacientes que tratados con hormona de crecimiento.
Niveles basales de IGFBP-3
Es el principal transportador de la IGF-1. Su síntesis también depende de la hormona de crecimiento y mantiene niveles en circulación relativamente constantes. Como marcador de déficit tiene una especificidad de 85 % y la sensibilidad varía de 64-84 %, es decir su especificidad excede su sensibilidad, esto significa que excepcionalmente vamos a encontrar niveles bajos en un niño sano. Valores normales no descartan un déficit de GH pero valores bajos son muy sugestivos de déficit moderado a severo. Sus valores se ven aumentados por hormona de crecimiento, insulina, hormonas tiroideas, glucocorticoides, andrógenos, estrógenos en bajas dosis, y se ven disminuidos por estrógenos en dosis elevadas, desnutrición, insuficiencia hepática, y enfermedades sistémicas.
Pruebas de estímulo farmacológico de secreción de hormona de crecimiento
Dado que la secreción de GH es pulsátil, para diagnosticar un déficit, se debe recurrir a las pruebas de estímulo farmacológico. Ciertas limitaciones en la reproducibilidad de dichas pruebas han hecho que fueran cuestionadas por algunos autores. La secreción de GH está influenciada por factores como obesidad, hipotiroidismo e hipercortisolismo que bloquean la respuesta de GH y también por pubertad o administración de esteroides sexuales que aumentan la respuesta. Debido que existen individuos normales que presentan una respuesta disminuida, se requieren al menos dos pruebas con estímulo con resultados por debajo de lo esperado para diagnosticar un paciente con déficit de hormona de crecimiento.
Las pruebas de estímulo se dividen en dos grandes grupos:
- a- Pruebas de tamizaje: prueba de ejercicio, o de estímulo con clonidina.
- b- Prueba confirmatoria: de estímulo con arginina.
La mayoría de estas pruebas se basan en el principio que los receptores alfa adrenérgicos estimulan la secreción de GH y los beta adrenérgicos la inhiben, por este motivo se utilizan fármacos alfa agonistas o beta antagonistas.
-
Prueba de ejercicio:
El ejercicio es un estímulo fisiológico de la liberación de GH por mecanismos adrenérgicos. Ha sido utilizada como una prueba de tamizaje para el déficit de GH debido a su bajo costo económico y también su simpleza a la hora de realizarla. El paciente debe realizar ejercicio moderado de 20 a 40 min y las extracciones se realizan 20 a 40 min después de realizado el ejercicio. Tiene una alta sensibilidad para diagnosticar un déficit de GH pero muy baja especificidad.
-
Prueba de Clonidina:
Es un agente alfa-2-adrenérgico que estimula la secreción de GHRH y en consecuencia la liberación de GH, siempre y cuando no exista elevación de niveles de somatostatina. La clonidina puede causar somnolencia e hipotensión ortostática, por lo tanto se debe controlar la presión arterial del paciente durante la prueba y luego de realizada la misma si hubo un episodio de hipotensión hasta normalización de la misma.
-
Prueba de L - Arginina:
Se utiliza Clorhidrato de Arginina por vía endovenosa. La arginina produce una estimulación sobre los receptores alfa-adrenérgicos con liberación de GHRH y al mismo tiempo reduce el tono somastotinérgico del hipotálamo. Debido a la producción de amonio no se debe administrar arginina en pacientes con insuficiencia hepática o renal severas, o acidosis. La respuesta de este estímulo puede ser insufi - ciente en casos de hipoestrogenemia, en estos casos se recomienda la administración previa de estrógenos. El test de arginina no presenta los riesgos que tienen otros test y en cuanto a la efectividad son similares, es el test de elección para diagnosticar una insuficiencia en el eje somatotrófico.
Valores de corte para las Pruebas de Estímulo:
Los valores de corte para diagnosticar un déficit de hormona de crecimiento con pruebas de estímulo están en constante discusión. Los primeros reportes habían establecido que un valor por encima de 10 ng/ml en uno de los puntos se consideraba respuesta normal. Estos valores fueron cambiando debido al constante avance de los métodos para dosar GH. En un principio se utilizaban anticuerpos policlonales, por lo cual se medían todas las formas circulantes de GH. En la actualidad se utilizan anticuerpos monoclonales que solo miden la fracción 22kDa, también es importante destacar que se debe tener en cuenta el Standard Internacional con el que fue trazada la técnica que se utiliza para la medición de GH. Debido a estos avances los valores fueron cambiando y en la actualidad se considera una respuesta anormal cuando ningún punto de la curva supera los 7 ng/ml, aunque actualmente ya hay trabajos que proponen un valor de 5 ng/ml.
Tratamiento
Dentro de los tratamientos disponibles para talla baja se pueden mencionar el uso de la hormona de crecimiento, análogos de la GnRH, andrógenos e inhibidores de la aromatasa. El tratamiento con hormona de crecimiento se utiliza hace varias décadas, en un principio solo era utilizada para deficiencias de dicha hormona, sin embargo desde el año 1985 que se creó la hormona recombinante mediante ingeniería genética, se amplió su utilización en otras patologías. En Argentina está indicada para el tratamiento de insuficiencia hipofisaria, Síndrome de Turner, insuficiencia renal crónica, Síndrome de Prader-Willi y restricción del crecimiento intrauterino, pero no está aprobada para el uso en los pacientes con talla baja idiopática, sin embargo en EEUU, en el año 2003, se aprobó la utilización del tratamiento para dichos pacientes. El Ministerio de Salud de la Nación Argentina cuenta con un programa de asistencia del tratamiento a personas que carecen de cobertura social. (4)
El objetivo de estos tratamientos durante la niñez, es alcanzar una talla adulta dentro de lo normal para su población y de esta manera permitir una adaptación psicosocial adecuada.
Requiere un seguimiento clínico y bioquímico constante por parte del especialista endocrinólogo pediatra y se debe sostener hasta que se fusionan los cartílagos de crecimiento y el paciente alcanza su estatura final.
Es un tratamiento que no tiene mayores complicaciones y es bien tolerado, se han reportado casos de lipodistrofia en el sitio de punción, aumento de nevus, ginecomastia, artralgias, hiperglucemia e intolerancia a la glucosa entre otros. (5)
Bibliografía
- Pozo J, Argente J. Hipocrecimiento armónico. En: Moro M, Málaga S, Madero L, ed. Cruz Tratado de Pediatría. (11ª edición). Madrid: Editorial Panamericana, S.A.; 2014. p. 1223-33
- Pozo Roman J. Crecimiento normal y talla baja. Pediatr Integral 2015; XIX (6): 411.e1?411.e23 3- Pombo M, Castro Feijoo L, Cabanas Rodriguez P. El niño con talla baja. Protocolo diagnóstico pediatría. 2011:1:236-54
- Comité Nacional de Endocrinología de la Sociedad Argentina de Pediatría. Actualización. Indicaciones actuales para el uso de la hormona de crecimiento. Arch Argent Pediatr 2014; 112 (1): 89:95
- Riquelme J. Linares J. Mericq V. Talla baja: enfoque diagnóstico y bases terapéuticas. Rev Venez Endocrinol Metab 2015; 13(2): 64-77
- MJ. Ceñal González-Fierro Dilemas diagnósticos y terapéuticos en talla baja. Servicio de Pediatría. Hospital de Móstoles. Móstoles, Madrid. España. Rev Pediatr Aten Primaria. 2009; 11 Supl 16:s155-s172.
- Aguirre, Miguel A et al. Enfoque Diagnóstico Inicial del Paciente con Talla Baja. Rev. Venez. Endocrinol. Metab., Mérida, octubre 2013 v. 11, n. 3, p. 168-179.
- Tercer consenso Argentino sobre patologías endocrinológicas. Buenos Aires. Agosto 2009.
Dra. Eliana Ayuso
Bioquímica
Dto. Endocrinología
IBC Instituto de Bioquímica Clínica