ARTICULO PARA COLEGAS
Reticulocitos. Evolución. Parámetros de utilidad clínica y diagnóstica
Los reticulocitos son glóbulos rojos inmaduros, con contenido de ARN y síntesis de Hemoglobina (Hb). Dicho contenido precipita con determinados colorantes in vitro, dando lugar a hematíes con imágenes reticulares y filamentosas en su interior, visibles al microscopio en un frotis y que dieron lugar al nombre de éstas células.
El proceso normal de maduración es en médula ósea (aprox. 2 días) y los estadios finales están asociados con la maduración en circulación (1-3 días). Este período depende del hematocrito (Hto) del paciente, siendo de aprox 1 día en condiciones clínicas normales; si el paciente está cursando cuadros anémicos ese período se extiende. Durante la división mitótica final del normoblasto hay una división desigual, donde la más pequeña de las dos células resultantes consiste en restos nucleares inactivos, dentro de una delgada capa de citoplasma, y la célula más grande se convierte en reticulocito. Aunque no tienen ADN detectable, los reticulocitos más tempranos tienen grandes cantidades de ARN residual y organelas subcelulares (mitocondrias, ribosomas y aparato de Golgi) asociadas con síntesis protéica. Así como la maduración de los reticulocitos progresa, su contenido de RNA disminuye. La manifestación morfológica más obvia es en el volumen celular; los reticulocitos son más grandes que las células rojas maduras. Los reticulocitos son también menos densos que los hematíes maduros, con un contenido de Hb que es aprox. 17% más bajo, consecuentemente corresponde a una población de hematíes macrocíticos hipocrómicos. La velocidad de producción de los reticulocitos está gobernada por las concentraciones de eritropoyetina.
Métodos de medición
A fines del siglo XIX existían evidencias de la existencia del material reticulofilamentoso en el interior de los reticulocitos pero desde 1940 la técnica de recuento manual mediante la precipitación y tinción con colorantes supravitales como el azul de metileno ó el azul brillante de cresilo y posterior observación microscópica; constituyó el método estándar. La incubación de la sangre con el colorante permite la precipitación del complejo colorante-ARN, que aparece como una malla reticulada ó gránulos (2 ó más) color azul oscuro en los eritrocitos teñidos de color azul pálido o verde azulado. Al menos se deben contar 1000 glóbulos rojos. Estas técnicas tienen la desventaja de tener altos CV (30 %) intra-operador e inter-operador, que obedecen al bajo conteo de células, variaciones en la coloración, variaciones en la distribución del frotis sanguíneo y también de la agudeza visual y experiencia del operador.
Durante la década de 1980 las técnicas de citometría de flujo en desarrollo y su aplicación en la detección y caracterización de subpoblaciones celulares hemáticas permitió la automatización del recuento reticulocitario. Las metodologías automatizadas, en la mayoría de los casos, son por tinciones de colorantes con características fluorescentes que ante la incidencia de luz láser emiten fluorescencia a una longitud de onda menor que la longitud de onda de la luz incidente. Hay distintos colorantes, de acuerdo al principio que utiliza el contador hematológico: naranja de thiazola, polimetina, oxacina, etc. El recuento electrónico eliminó el error estadístico y la falta de reproducibilidad respecto del método manual, ya que se examinan miles de células (30000 / mm3 ) por muestra. Los CV obtenidos de diferentes contadores hematológicos dan prueba de una mayor precisión (CV < 12%).
Tanto para el método manual como automatizado la muestra debe procesarse dentro del día de extracción, ya que el tiempo y la temperatura subestiman el resultado por maduración reticulocitaria. Pueden presentarse algunas interferencias como recuentos altos de leucocitos, plaquetas gigantes y agregados plaquetarios, parásitos, inclusiones celulares pero en general el contador hematológico los distingue sin dificultades.
El CAP - Colegio Americano de Patólogos (que regula las actividades del laboratorio clínico en EEUU) a partir de 1993 sólo acredita el recuento de reticulocitos por métodos automáticos.
Expresión de Resultados
Se puede expresar en valores relativos y/ó absolutos. El valor porcentual es necesario referirlo al Hto del paciente
Ret corregidos= (%Ret pacte x Hto pacte) / Hto normal p/pcte
También se puede calcular el índice de producción de reticulocitos (IPR) que proporciona una estimación de la tasa de eritropoyesis efectiva comparada con la tasa normal de maduración del reticulocito en sangre periférica correspondiente a un día. Depende del valor del Hto.
IPR = IRC / factor = (%ret x Hto pacte / Hto normal) / factor
Está en relación inversa al Hto. F=1 cuando Hto: 45% Un índice > 2 indica aumento de la actividad eritropoyética.
Reticulocitosis (aumento eritropoyesis) se da en respuesta a hemorragia, anemias hemolíticas, tratamiento de anemias nutricionales, anemia megaloblástica, en ciertos tipos de cáncer, por drogas y esplenectomía.
Reticulopenia (disminución eritropoyesis) en aplasia, déficit de vitaminas y oligoelementos, tratamiento con citostáticos, déficit de eritropoyetina (EPO), caquexia.
La ventaja de la automatización de esta práctica, es la estandarización de las condiciones de reacción por un lado e independencia del operador pero además permite la obtención de datos adicionales brindados que son de utilidad clínica para diagnóstico, seguimiento de los tratamientos, monitoreo de la respuesta medular por ejemplo en casos de transplante de MO.
Los parámetros reticulocitarios adicionales que se obtienen mediante el recuento automatizado son:
-
Parámetros de inmadurez reticulocitaria
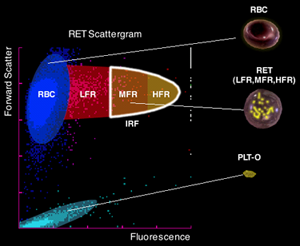
IRF - Fraccion de Reticulocitos Inmaduros. Se considera un marcador precoz de la actividad eritropoyética. La población analizada se divide en tres fracciones de acuerdo al grado de absorción de la luz, intensidad de la fluorescencia en relación a la magnitud de la tinción y su contenido de RNA. Así se obtienen las tres poblaciones siguientes:
- LFR: Ret. de baja fluorescencia (más maduros)
- MFR: Ret. con mediana fluorescencia
- HFR: Ret. con mayor fluorescencia, mayor contenido de RNA (más inmaduros)
El IRF se obtiene mediante la suma de MFR y HFR Durante la regeneración medular el aumento de IRF en sangre periférica se produce antes del incremento absoluto del número de reticuloticos, por lo que se considera un marcador precoz de la actividad eritropoyética.
IRF=MFR+HFR
-
Parámetros de Hemoglobina reticulocitaria
RET-He - Hemoglobina reticulocitaria equivalente mide la incorporación de hierro en el eritrocito. Proporciona una evaluación directa de la actividad de la médula ósea. Desde el punto de vista clínico posee la misma utilidad que CHr (contenido de Hb reticulocitaria) y se expresa en iguales unidades. Ante un grado de deficiencia de hierro, este valor se encuentra disminuido. Como dijimos, los reticulocitos son los precursores de los eritrocitos, por ello en casos de déficit de hierro, las primeras células que se anemizan son los reticulocitos. El grado de deficiencia de hierro, estaría representado por el parámetro RET-He.
En pacientes en tratamiento de quimioterapia, transplante de M.O. ó tratamiento con EPO se demostró que cuando ocurre un cambio repentino de la eritropoyesis el cambio en MCVr, medido en algunos contadores hematológicos, ocurre mucho más temprano que MCVGR. Es una medida útil para el monitoreo de la eritropoyesis en tiempo real, igual que RET-He (CHr) reflejando el balance entre Fe y la eritropoyesis de 48 hs previas.
Utilidad de los índices reticulocitarios en el diagnóstico
Distintos trabajos publicados demuestran que RET-He y receptores solubles de transferrina son los marcadores más precoces para detectar déficit funcional de hierro y anemia por déficit de hierro. Los índices permiten evaluar función eritropoyética, déficit funcional de hierro, monitorear la respuesta a tratamientos y post transfusional.
En cuanto a su uso en anemia por déficit de hierro se presenta con RET-He < 25 pg, depleción de los depósitos y del hierro funcional y hemoglobinización de glóbulos rojos.
El déficit funcional de Fe se produce durante la estimulación intensa de la eritropoyesis (por la Eritropoyetina endógena ó el tratamiento con agentes estimulantes de la eritropoyetina) cuando la movilización de Fe de los macrófagos en el SRE no es suficientemente rápida como para satisfacer las necesidades de la M.O. pese a que los depósitos de Fe del organismo son suficientes. Depósitos llenos pero no disponibles, con RET-He normal.
En el caso de anemia asociada a procesos inflamatorios agudos ó crónicos, cáncer y procesos infecciosos se observa un déficit relativo ó baja disponibilidad de Fe (por secuestro del mismo). El secuestro del Fe está impulsado por el sistema inmunitario (TNF, IL-1, IL-6 y IFN?) que aumenta los niveles de hepcidina, hormona reguladora de la homeostasis del Fe, bloqueando la exportación del Fe desde las células del SRE y enterocitos. En consecuencia la disponibilidad del Fe para los precursores eritroides es menor y termina provocando anemia. Se observa RET-He> 25 pg, más sensible que otros parámetros bioquímicos influenciados por procesos inflamatorios y variaciones biológicas
En pediatría se realizaron estudios analizando RET-He como diagnóstico de ferropenia. La conclusión indicó la mayor efectividad de RET-He que los índices convencionales para detectar déficit de hierro antes de su progresión a anemia siendo la RET-He el único indicador significativo de anemia ferropénica. RET-He 25 pg como valor de corte mostró mayor sensibilidad y especificidad indicando anemia por déficit de hierro cuando es menor de 25 pg
Estudios en pacientes adultos con neoplasias hematológicas y en tratamiento se demostró que RET-He es un parámetro útil para detectar déficit funcional de Fe y también de alta sensibilidad para detectar en forma temprana la eficacia del transplante de M.O.
En pacientes sometidos a hemodiálisis estudiados durante 12 días de tratamiento consecutivo en las sesiones de diálisis para evaluar el estado del hierro se concluyó que los niveles de Hb, Hto y RET-He proporcionan variaciones biológicas pequeñas comparadas con % sat Tra y Ferritina, siendo estos últimos ineficaces. Las variaciones analíticas fueron similares para todos los analitos. En otro grupo de pacientes en diálisis se analizó RET-He para evaluar el estado del hierro; concluyéndose que RET-He < 26 pg es una medida segura del estado del hierro en pacientes en diálisis y que CHr < CHM indica el comienzo agudo de un déficit de hierro.
Informe de resultados
En el laboratorio hemos determinado el valor de corte de nuestra población de pacientes para IRF y RET-He siendo:
- IRF: Menor a 20.0 %
- RET-He: Mayor a 25.0 pg
En cuanto a los recuentos los valores determinados son:
| % | Absoluto x 10³ / ul | |
| Adultos | 0.30 - 3.00 | 22.0 - 132.0 |
| R. Nacido | 2.00 - 6.00 | 88.0 - 270.0 |
En resúmen, los nuevos métodos para el recuento automatizado de reticulocitos brindan las siguientes posibilidades:
- La alta precisión del recuento automatizado hace posible detectar el descenso de la actividad eritropoyética y detectar cambios por el monitoreo seriado de los recuentos, independizándolos de la variación analítica de los métodos manuales.
- Valorar el IRF y la determinación del porcentaje relativo de los reticulocitos más jóvenes en particular, permite detectar pequeñas variaciones de la actividad eritropoyética.
- Los índices reticulocitarios reflejan el tamaño, concentración y contenido de hemoglobina de las células rojas recientemente liberadas desde la médula ósea y permiten ser usados como un indicador objetivo de cambios cualitativos en la eritropoyesis.
Estos avances permiten realizar diagnósticos tempranos y anticipar respuestas a tratamientos en la evaluación de las anemias mediante la detección de pequeñas alteraciones de la actividad eritropoyética en M.O. con la misma muestra del hemograma.
Bibliografía
- Poster Congreso Hematologia Nov. 2003 Puede la Hb reticulocitaria diferenciar B-talasemia menor de Anemia Ferropénica
- Parámetros hematimétricos y bioquímicos para valorar el status férrico. Servicio Hematología Hospital Universitario de Salamanca
- Reticulocytes: Methods and Clinical Applications. An Abbott Educational Monograph May 1996
- Reticulocytes: Methods and Clinical Applications. An Abbott Educational Monograph May 1996
- Automated Reticulocyte Counting and Measurement of Reticulocyte Cellular Indices. Am J Clin Pathol 1994; Vol 102:623-632
- Analysis of Manual Reticulocyte Counting. Am J Clin Pathol Vol 76: 713-717, 1981
- Reticulocyte hemoglobin content in the evaluation of iron status of hemodialyis patients. Kidney International, Vol 52 (1997), pp 217-222
- Reticulocyte Hemoglobin Content to diagnose Iron Deficiency in Children.JAMA, june 16, 1999-Vol 281, N°23 pp 2225-2230
- Reticulocyte Count as an indicator of the rate of erythropoiesis. Am J Clin Pathol Vol 39,N° 2, pp 121-128. February 1963
- Reticulocyte Hemoglobin Content: early indicator of iron deficiency and response to the therapy. Trabajo realizado en Children´s Hospital and The Vol XX,N°X (Month),2010:ppxxx
- Reticulocyte hemoglobin measurement-comparison of two methodsmin the diagnosis of iron-restricted erythropoiesis. Clin Chem Lab Med 2005;43(11):1193-1202
- Iron. Metabolism, Iron Deficiency an Anaemis. Rolf Hinzmann,M.D.,Ph.D.
- Analytical and Biological Variation in Measures of Anemia and Iron Status in Patients Treated With Maintenance Hemodialysis. David B. Van Wyck, MD Harry Alcorn Jr, PharmD, and Resmi Gupta, MS
Dra. Graciela Palma
Dra. Gabriela Aguerri
Departamento Hematología
IBC Instituto de Bioquímica Clínica